Introducción a la EBM para Yacimientos de Gas.
Introducción a la EBM para Yacimientos de Gas.
Conceptos básicos:
Gas Ideal:
Para que un gas pueda ser considerado ideal se debe cumplir lo siguiente:
Las moléculas no colapsen entre ellas.
Las moléculas no exhiben fuerzas de atracción o repulsión.
Un mol de cualquier gas ideal contiene el mismo número de moléculas y ocupa el mismo volumen a las mismas condiciones de presión y temperatura.
La Ecuación general que define a los gases ideales esta dada por la siguiente:
PV= nRT
Esta expresión nace gracias a las leyes implantadas o realizadas por Boyle, Charles, Avogadro, en donde cada uno de los términos asociados a dicha ecuación están relacionados.
R= Constante Universal de los Gases.
P= Presión del gas sobre las paredes del recipiente que las contiene.
N= Número de moles.
T= Temperatura a la que se encuentra el gas.
V= Volumen que ocupa.
R= 10.73 (lpc*ft3) / (lbmol* R) varia en función de las unidades en que se este trabajando.
Gases Reales:
§ Las moléculas que conforman ese gas empiezan a tener interacción entre ellas.
§ La sumatoria del volumen de esas moléculas no es despreciable.
Un gas real, es una colección de moléculas en movimientos donde las moléculas pueden chocar entre ellas. Las fuerzas de atracción o repulsión que ya no van hacer consideradas despreciables, van a depender básicamente del tamaño del campo de electrón y posición del núcleos positivos.
A condiciones de yacimientos los gases se desvían del comportamiento ideal por lo tanto es necesario realizar una corrección a la ecuación de estado de los gases ideales utilizando el factor de compresibilidad de los gases (Z).
PV = ZnRT.
Importancia del valor de Z.
Sabemos que, nuestro yacimiento va estar sometido a una determinada presión, y esa presión generalmente va a tener un valor lejano a las condiciones atmosféricas, esto significa que nuestro sistema no puede ser considerado como un gas ideal sino como un gas real; entonces tenemos que determinar de alguna forma cuanto es el valor el parámetro Z, que esta siendo introducido en la ecuación de estado de los gases ideales de manera de transformar ese comportamiento de gas ideal a gas real.
El valor de Z se puede obtener experimentalmente al dividir el volumen real de n moles de un gas a Presión y Temperatura por el volumen ideal ocupado por la misma masa de gas iguales condiciones de P y T.
También se puede calcular matemáticamente de la siguiente forma:
Principio de estado correspondiente de Van Der Waals 1856
Establece que todos los gases tienen el mismo factor de compresibilidad iguales condiciones de presión t temperatura reducidas.
Entonces el Z es va ser una función que va a depender de la Presión y temperatura reducidas.
Z = F (Pr, Tr)
Donde la Presión Reducida va ser igual a la presión entre la presión critica.
Y la Temperatura Reducida es igual a la Temperatura entre la temperatura critica.
Principio de los estados correspondientes de W. B. Kay 1936
Kay para esta fecha aplico el principio de estado correspondiente pero para una mezcla de hidrocarburos, entonces en este caso se dice que todas las mezclas de HC tienen el mismo factor de compresibilidad a iguales condiciones de P y T seudoreducidas. Entonces Z va ser una función que depende de la P y T seudoreducidas de la mezcla.
Z = F (Psr, Tsr).
Donde:
Psr = P / Psc.
Tsr = T / Tsc.
Donde Psc. y Tsc. Son propiedades seudocríticas.
La P y T seudocríticas, se obtienen en base a la composición del gas.
Una vez conocido los parámetros seudo reducidos se puede determinar el valor de Z gracias a la grafica realizada por Standing y Katz.
Standing y Katz realizaron una grafica en el que a partir de la Presión y Temperatura seudo reducidas se pudiera determinar el factor de compresibilidad de la mezcla, es decir ellos determinaron de forma experimental el comportamiento de Z con diferentes valores de presión y temperatura seudo reducidas y graficaron el su resultado, pudiéndose así obtener el valor de Z gráficamente.
Factor Volumétrico de Formación del Gas.
Se define como una relación entre el volumen de gas a condiciones de yacimiento y el volumen de gas a condiciones de superficie.
Bg = 0.00504 ZT / P.
Nota: Para recordar...
En los yacimientos de gas vamos a tener generalmente dos tipos de yac.
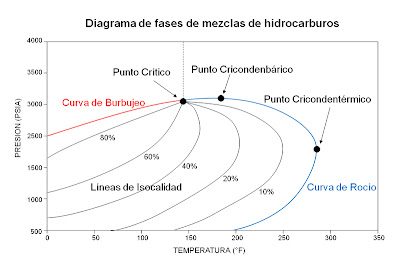
1) Un yacimiento en el cual la temperatura sea superior a la temperatura cricondentérmica nos referimos a yacimientos de gas seco. Esto quiere decir que ni a las condiciones de yacimiento ni a las de superficie se entra en la región de dos fases durante el agotamiento de presión del yacimiento, por lo que la mezcla de HC se encuentra siempre en fase gaseosa.
2) Cuando la presión del yacimiento se encuentre entre la presión crítica y el punto cricondertérmico nos referimos a un yacimiento de gas condensado.
Conceptos básicos:
Gas Ideal:
Para que un gas pueda ser considerado ideal se debe cumplir lo siguiente:
Las moléculas no colapsen entre ellas.
Las moléculas no exhiben fuerzas de atracción o repulsión.
Un mol de cualquier gas ideal contiene el mismo número de moléculas y ocupa el mismo volumen a las mismas condiciones de presión y temperatura.
La Ecuación general que define a los gases ideales esta dada por la siguiente:
PV= nRT
Esta expresión nace gracias a las leyes implantadas o realizadas por Boyle, Charles, Avogadro, en donde cada uno de los términos asociados a dicha ecuación están relacionados.
R= Constante Universal de los Gases.
P= Presión del gas sobre las paredes del recipiente que las contiene.
N= Número de moles.
T= Temperatura a la que se encuentra el gas.
V= Volumen que ocupa.
R= 10.73 (lpc*ft3) / (lbmol* R) varia en función de las unidades en que se este trabajando.
Gases Reales:
§ Las moléculas que conforman ese gas empiezan a tener interacción entre ellas.
§ La sumatoria del volumen de esas moléculas no es despreciable.
Un gas real, es una colección de moléculas en movimientos donde las moléculas pueden chocar entre ellas. Las fuerzas de atracción o repulsión que ya no van hacer consideradas despreciables, van a depender básicamente del tamaño del campo de electrón y posición del núcleos positivos.
A condiciones de yacimientos los gases se desvían del comportamiento ideal por lo tanto es necesario realizar una corrección a la ecuación de estado de los gases ideales utilizando el factor de compresibilidad de los gases (Z).
PV = ZnRT.
Importancia del valor de Z.
Sabemos que, nuestro yacimiento va estar sometido a una determinada presión, y esa presión generalmente va a tener un valor lejano a las condiciones atmosféricas, esto significa que nuestro sistema no puede ser considerado como un gas ideal sino como un gas real; entonces tenemos que determinar de alguna forma cuanto es el valor el parámetro Z, que esta siendo introducido en la ecuación de estado de los gases ideales de manera de transformar ese comportamiento de gas ideal a gas real.
El valor de Z se puede obtener experimentalmente al dividir el volumen real de n moles de un gas a Presión y Temperatura por el volumen ideal ocupado por la misma masa de gas iguales condiciones de P y T.
También se puede calcular matemáticamente de la siguiente forma:
Principio de estado correspondiente de Van Der Waals 1856
Establece que todos los gases tienen el mismo factor de compresibilidad iguales condiciones de presión t temperatura reducidas.
Entonces el Z es va ser una función que va a depender de la Presión y temperatura reducidas.
Z = F (Pr, Tr)
Donde la Presión Reducida va ser igual a la presión entre la presión critica.
Y la Temperatura Reducida es igual a la Temperatura entre la temperatura critica.
Principio de los estados correspondientes de W. B. Kay 1936
Kay para esta fecha aplico el principio de estado correspondiente pero para una mezcla de hidrocarburos, entonces en este caso se dice que todas las mezclas de HC tienen el mismo factor de compresibilidad a iguales condiciones de P y T seudoreducidas. Entonces Z va ser una función que depende de la P y T seudoreducidas de la mezcla.
Z = F (Psr, Tsr).
Donde:
Psr = P / Psc.
Tsr = T / Tsc.
Donde Psc. y Tsc. Son propiedades seudocríticas.
La P y T seudocríticas, se obtienen en base a la composición del gas.
Una vez conocido los parámetros seudo reducidos se puede determinar el valor de Z gracias a la grafica realizada por Standing y Katz.
Standing y Katz realizaron una grafica en el que a partir de la Presión y Temperatura seudo reducidas se pudiera determinar el factor de compresibilidad de la mezcla, es decir ellos determinaron de forma experimental el comportamiento de Z con diferentes valores de presión y temperatura seudo reducidas y graficaron el su resultado, pudiéndose así obtener el valor de Z gráficamente.
Factor Volumétrico de Formación del Gas.
Se define como una relación entre el volumen de gas a condiciones de yacimiento y el volumen de gas a condiciones de superficie.
Bg = 0.00504 ZT / P.
Nota: Para recordar...
En los yacimientos de gas vamos a tener generalmente dos tipos de yac.
1) Un yacimiento en el cual la temperatura sea superior a la temperatura cricondentérmica nos referimos a yacimientos de gas seco. Esto quiere decir que ni a las condiciones de yacimiento ni a las de superficie se entra en la región de dos fases durante el agotamiento de presión del yacimiento, por lo que la mezcla de HC se encuentra siempre en fase gaseosa.
2) Cuando la presión del yacimiento se encuentre entre la presión crítica y el punto cricondertérmico nos referimos a un yacimiento de gas condensado.